Enzim: Konsep Dasar dan
Kinetika
Enzim,
yang merupakan katalis sistem biologi, adalah perangkat molekul yang luar biasa
yang menentukan pola transformasi kimia. Mereka
juga memediasi transformasi dari satu bentuk energi ke bentuk yang lain. Karakteristik paling mencolok dari enzim adalah daya
katalitik dan spesifisitas. Katalisis terjadi pada situs tertentu pada enzim
yang disebut situs aktif. Hampir semua enzim yang dikenal adalah
protein. Namun, protein bukan merupakan satu-satunya
yang mutlak pada katalisis, penemuan molekul RNA katalitik aktif memberikan
bukti kuat bahwa RNA adalah biokatalis awal.
Protein
sebagai kelas makromolekul merupakan katalis yang sangat efektif untuk
keragaman yang besar besar dari reaksi kimia karena kapasitas mereka untuk
secara khusus mengikat rentang yang sangat luas dari molekul. Dengan
memanfaatkan repertoar yang penuh gaya antarmolekul, enzim membawa substrat
bersama-sama dalam orientasi yang optimal, pendahuluan untuk membentuk dan memutuskan
ikatan kimia. Mereka mengkatalisis reaksi dengan menstabilkan keadaan transisi,
energi-tertinggi spesies dalam jalur reaksi. Dengan selektif menstabilkan
keadaan transisi, enzim menentukan salah satu dari beberapa reaksi kimia
potensial sebenarnya terjadi.
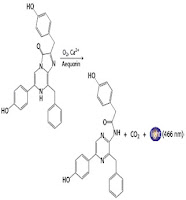
Aktivitas enzim yang mengakibatkan/membuat cahaya pada ubur-ubur bercahaya pada gambar di sebelah kiri. Enzim aequorin mengkatalisis oksidasi senyawa dengan oksigen sesudah kalsium untuk melepaskan CO2 dan cahaya. [Fred Bavendam/Peter Arnold.]
1. Enzim Katalis Kuat dan Sangat Spesifik
Enzim mempercepat reaksi oleh faktor sebanyak satu juta
atau lebih (Tabel 8.1). Memang, sebagian besar reaksi dalam biologi sistem tidak terjadi pada tingkat jelas
dalam ketiadaan enzim. Bahkan reaksi yang sederhana seperti hidrasi karbon dioksida dikatalisis oleh enzim
yaitu, karbonat anhidrase (Bagian 9.2). Transfer CO2
dari jaringan ke dalam darah dan kemudian ke
rongga udara akan kurang lengkap tanpa adanya
enzim ini. Bahkan, selama ini dikenal karbonat anhidrase adalah salah satu enzim
tercepat. Setiap molekul enzim bisa 106 molekul CO2 hidrat per
detik.
Reaksi yang dikatalisis
adalah 107 kali lebih cepat dari salah satu reaksi tanpa katalis. Enzim sangat spesifik baik dalam reaksi yang mereka
mengkatalisasi dan dalam pilihan reaktannya, yang disebut
substrat. Enzim biasanya mengkatalisis reaksi kimia tunggal atau satu set erat reaksi terkait. Reaksi samping yang
mengarah pada pembentukan reaksi
yang membentuk pemborosan oleh-produk yang langka di dikatalisis enzim-reaksi, berbeda dengan yang tanpa
katalis.
Mari kita mempertimbangkan enzim proteolitik sebagai contoh. In vivo, enzim
ini mengkatalisis proteolisis, hidrolisis dari ikatan peptida.
Kebanyakan enzim proteolitik juga mengkatalisis reaksi yang berbeda tetapi terkait secara in vitro yaitu hidrolisis dari ikatan ester.Reaksi ini lebih mudah dimonitor daripada yang proteolisis dan berguna dalam penyelidikan eksperimental ini enzim.
Enzim proteolitik berbeda dalam derajat spesifisitas
substratnya. Subtilisin, yang ditemukan pada
bakteri tertentu, cukup tidak membeda-bedakan: ia akan
membelah setiap ikatan peptida dan sebagian rantai samping yang
berdekatan. Tripsin yang merupakan enzim pencernaan, ini cukup spesifik dan mengkatalisis
pemecahan ikatan peptida hanya pada sisi karboksil dari residu lisin dan arginin (Gambar 8.1a). Trombin yang merupakan suatu enzim yang berpartisipasi dalam pembekuan darah,
bahkan lebih spesifik dari tripsin. Ini
mengkatalisis hidrolisis ikatan Arg-Gly di urutan peptida tertentu saja
(Gambar 8.1B). DNA polimerase I yang merupan enzim penyebab-template, juga merupakan katalis yang sangat spesifik. Ia menambahkan
nukleotida untuk sebuah untai DNA yang sedang
disintesis, dalam urutan yang ditentukan oleh urutan nukleotida dalam untai DNA
lain yang berfungsi sebagai template. DNA
polimerase I sangat tepat dalam melaksanakan petunjuk yang diberikan oleh
template. Ini memasukkan nukleotida yang salah ke
dalam untai DNA baru kurang dari satu per
satu juta kali. Kekhususan dari enzim adalah karena
interaksi yang tepat dari substrat dengan enzim. Presisi ini adalah hasil dari struktur tiga dimensi rumit dari enzim
protein.
1.1. Banyak Enzim Perlu kofaktor untuk Aktivitas
Aktivitas
katalitik enzim banyak tergantung pada keberadaan molekul kecil disebut
kofaktor, meskipun peran yang tepat bervariasi dengan kofaktor dan enzim.
Seperti enzim tanpa kofaktor adalah disebut sebagai suatu apoenzyme; enzim,
lengkap katalis aktif disebut holoenzyme suatu. Kofaktor dapat dibagi menjadi
dua kelompok:
Apoenzyme + cofactor = holoenzyme
Kofaktor dapat dibagi
lagi menjadi dua bagian yakni logam dan molekul organik kecil. Enzim
karbonat anhidrase, misalnya, membutuhkan Zn2+ untuk aktivitasnya). Glikogen fosforilase yang memobilisasi glikogen untuk energi,
membutuhkan molekul fosfat organik kecil piridoksal (PLP).
Kofaktor
yang molekul organik kecil yang disebut koenzim. Seringkali
berasal dari vitamin, koenzim dapat terikat
enzim secara erat atau longgar. Jika terikat erat, mereka disebut
kelompok prostetik. Longgar terkait koenzim
lebih seperti cosubstrat karena mereka mengikat dan dilepaskan dari enzim hanya
sebagai substrat dan produk. Penggunaan
koenzim yang sama oleh berbagai enzim dan sumber vitamin set koenzim terpisah
dari substrat normal, namun. Enzim yang menggunakan koenzim yang sama
biasanya merupakan mekanis yang serupa.
1.2. Enzim
mampu transform energi dari satu bentuk ke bentuk lain
Dalam
banyak reaksi biokimia, energi dari reaktan diubah dengan efisiensi tinggi
menjadi sebuah bentuk yang berbeda. Misalnya, dalam fotosintesis, energi cahaya
diubah menjadi energi ikatan kimia melalui gradien ion. Dalam
mitokondria, energi bebas yang terkandung dalam
molekul kecil yang berasal dari makanan diubah terlebih dahulu ke dalam energi
bebas dari gradien ion dan kemudian ke bentuk yang berbeda, energi bebas dari Enzim
adenosin trifosfat. kemudian dapat
menggunakan energi ikatan kimia ATP dengan banyak
cara. Enzim myosin mengubah energi ATP ke energy mekanik otot. Pompa dalam membran sel dan organel, yang dapat
dianggap sebagai enzim yang bergerak melakukan perubahan cenderung berbentuk substrat
daripada kimiawi, membuat gradien kimia dan listrik dengan menggunakan energi
ATP untuk mengangkut molekul dan ion (Gambar. 2). Mekanisme molekuler
dari energi-pentransduksi enzim yang terurai.
1.3. Enzim menklasifikasi pada Dasar Jenis Reaksi katalisis.
Banyak
enzim memiliki nama umum yang memberikan informasi sedikit tentang reaksi yang
mereka mengkatalisasi. Sebagai contoh, sebuah enzim
proteolitik disekresikan oleh pankreas disebut tripsin. Kebanyakan enzim lain
yang dinamakan substrat mereka dan untuk reaksi
yang mereka mengkatalisasi, dengan "ase" akhiran ditambahkan. Jadi,
ATPase adalah enzim yang memecah ATP, sedangkan
ATP sintase adalah enzim yang mensintesis ATP.
Untuk
membawa konsistensi beberapa klasifikasi enzim, pada tahun 1964 International
Union of Biochemistry didirikan sebuah Komisi Enzim untuk mengembangkan
tata-nama untuk enzim. Reaksi
dibagi ke dalam enam kelompok besar bernomor 1 sampai 6 (Tabel 8.3).
Kelompok-kelompok ini dibagi dan kemudian dibagi lagi, sehingga angka empat
digit didahului oleh surat Komisi Eropa untuk
Komisi Enzim justru bisa mengidentifikasi semua enzim.
Pertimbangkan sebagai
contoh nukleosida monofosfat (NMP) kinase,
Transfer NMP kinase kelompok
fosforil dari ATP untuk NMP ke nukleosida difosfat membentuk (NDP) dan ADP. Akibatnya,
itu adalah transferase, atau anggota kelompok 2. Banyak kelompok di samping
kelompok fosforil, seperti gula dan karbon unit, dapat ditransfer. Berbagai
fungsional kelompok dapat menerima kelompok
fosforil. Jika fosfat adalah akseptor, yang transferase ditunjuk 2.7.4.
Final menunjuk sejumlah akseptor lebih tepat. Dalam kaitan dengan NMP kinase,
nukleosida monofosfat adalah akseptor, dan
penunjukan enzim adalah EC 2.7.4.4. Meskipun nama-nama yang umum
digunakan secara rutin, jumlah klasifikasi digunakan ketika identitas tepat
dari enzim mungkin merupakan suatu ambigu.
Gambar. 1.
Enzim khusus. (A)
Trypsin memotong pada
sisi karboksil residu arginin dan lisin, sedangkan (B) trombin memotong
ikatan
Arg-Gly dalam urutan tertentu secara
khusus.
Tabel. 2. Kofaktor
enzim
KOFAKTOR
|
ENZIM
|
KOFAKTOR
|
ENZIM
|
KOENZIM
|
LOGAM
|
||
Thiamine pyrophosphate
|
Pyruvate dehydrogenase
|
Zn2+
|
Carbonic anhydrase
|
Flavin adenine nucleotide
|
Monoamine oxidase
|
Zn2+
|
Carboxypeptidase
|
Nicotinamide adenine
dinucleotide
|
Lactate dehydrogenase
|
Mg2+
|
EcoRV
|
Pyridoxal phosphate
|
Glycogen phosphorylase
|
Mg2+
|
Hexokinase
|
Coenzyme A (CoA)
|
Acetyl CoA carboxylase
|
Ni2+
|
Urease
|
Biotin
|
Pyruvate carboxylase
|
Mo
|
Nitrate reductase
|
5 -Deoxyadenosyl cobalamin
|
Methylmalonyl mutase
|
Se
|
Glutathione peroxidase
|
Tetrahydrofolate
|
Thymidylate synthase
|
Mn2+
|
Superoxide dismutase
|
K+
|
Propionyl CoA carboxylase
|
Gambar 2.
Energi Transformasi enzim. Ca2+
ATPase menggunakan energi dari hidrolisis ATP untuk
mengangkut Ca2+ di
membran, menghasilkan gradien Ca2+.
KELAS
|
JENIS REAKSI
|
CONTOH
|
1. Oxidoreductases
|
Oksidasi-reduksi
|
Lactate dehydrogenase
|
2. Transferases
|
Transfer group
|
Nucleoside monophosphate kinase (NMP kinase)
|
3. Hydrolases
|
Reaksi hidrolisis (transfer gugus
fungsional ke air)
|
Chymotrypsin
|
4. Lyases
|
Adisi atau pelepasan gugus menjadi ikatan
rangkap.
|
Fumarase
|
5. Isomerases
|
Isomerisasi (intramolecular group transfer)
|
Triose phosphate isomerase
|
6. Ligases
|
Pembentukan ligan dua subtract pada
ekspansi hidrolisis ATP
|
Aminoacyl-tRNA synthetase
|
REFERENSI:
Jeramy M. Berg., John L. Tymoczko dan Lubert
styer “Biochemistry fifth edition” W.H. Freeman and Company.







No comments:
Post a Comment